Rev. Méd. RosaRio 86: 123-130,
2020
![]()
CORRELACIÓN DEL FILTRADO
GLOMERULAR CON LA ECUACIÓN CKD-EPI EN PACIENTES CON RIÑÓN HIPERFILTRANTE
MaRía Malén Pijoán*
Especialista Jerarquizada y
Consultor en Urología. Especialista en Andrología.
Dra. en Medicina.
Instituto Metropolitano de Urología, Rosario, Santa Fe,
Argentina. Bv. Oroño 1483. CP 2000. Tel.: + 54 9 0341 4896464.
Recibido: 02-05-2020
Aprobado para publicación:
21-09-2020
Resumen
La estimación de la filtración glomerular es una variable de extensa utilización clínica y posee una importancia trascendental respecto a una amplia toma de decisiones. Entre ellas, el ajuste de la dosis de fármacos debe ser adaptado a modificaciones del valor de la filtración glomerular ya que dosis fuera del rango terapéutico conducen a concentraciones plasmáticas que se alejan del objetivo del tratamiento. La disminución de la filtración glomerular puede ocasionar dosis supra óptimas de un fármaco dado ocasionado mayor probabilidad de efectos adversos graves, incluso potencialmente fatales. Es por esta razón que la disminución de la dosis de antibióticos se efectúa según el valor de la filtración glomerular obtenido por fórmulas predictivas como la de Cockroft y Gault. Sin embargo, hasta la fecha, no existe ninguna fuente académica que proponga incrementar la dosis de antibióticos ante un incremento de la filtración glomerular. Dentro de las fórmulas predictivas figuran una amplia variedad y todas han sido testeadas en la clínica a excepción de la fórmula CKD-EPI. Ninguna de las fórmulas citadas posee buena correlación con altos valores de filtración glomerular salvo la CKD-EPI que no ha sido estudiada en este aspecto. El análisis de la validez de la fórmula CKD-EPI en pacientes con tasa de filtración glomerular aumentado (riñón hiperfiltrante) puede aportar un dato de suma importancia que podría contribuir a modificar el tratamiento y promover su optimización. Los resultados en la muestra poblacional analizada constituida por 31 pacientes y tras el análisis estadístico no se encuentra una correlación entre los valores de clearance de creatinina de riñones hiperfiltrantes determinada por orina de 24 horas con los valores correlativos estimados por las fórmulas CKD-EPI y MDRD.
Palabras clave:
Velocidad de filtración glomerular, MDRD, CKD-EPI.
CORRELATION OF GLOMERULAR FILTRATE WITH CKD-EPI
ECUATION IN PATIENTS
WITH RENAL HYPERFILTRATION
Abstract:
The estimation of glomerular filtration is a variable
of extensive clinical
use and has a transcendental importance regarding a broad
decision making. Among
them, the adjustment of the drug dose must
be adapted to modifications of the glomerular filtration value,
since doses outside
the therapeutic range result in plasma concentrations that move away from the treatment
objective. Decreased glomerular filtration may result
in supraoptimal doses of a given drug causing increased
likelihood of
![]()
serious, even potentially fatal, adverse effects.
It is for this reason
that the decrease
in antibiotic dose
is made according to the value of glomerular filtration obtained by predictive formulas such as Cockroft and Gault. However, to date, there is
no academic source that proposes
increasing the dose
of antibiotics in the face
of increased glomerular filtration. Predictive
formulations include a wide variety
and all have been tested
in the clinic with the exception of the CKD-EPI
formula. None of the mentioned formulas
has a good correlation with high values
of glomerular filtration except the CKD-EPI that has not been studied in this aspect.
The analysis of the validity
of the CKD¬EPI formula in patients with increased
glomerular filtration rate
(hyperfiltrating kidney) may provide a very important data that could
contribute to modify
the treatment and promote
its optimization.
The results in the analyzed
population sample constituted by 31 patients
and after the statistical analysis
no correlation was found between the values
of creatinine clearance of hyper filtered kidneys from 24 hours urine
with the correlative values estimated by the CKD-EPI and MDRD formulas.
Keywords: Glomerular filtration velocity, MDRD,
CKD-EPI.
Introducción
Un concepto emergente en el ámbito de la nefrología es el de riñón hiperfiltrante (RH). Éste hace referencia al incremento de la velocidad o tasa de filtración glomerular (TFG) y es detectado mayoritariamente en pacientes con patología crítica. Una variable de suma controversia es la estimación de la TFG en este particular grupo de pacientes. Históricamente se han utilizado diferentes métodos para poder estimar la TFG; clínicamente el método más utilizado es el clearance de creatinina, método que requiere recolección de orina de 24 horas.
El uso de ecuaciones para estimar la TFG basadas en la creatinina sérica (Crs) provee una evaluación más segura comparada con la determinación de la Crs sola, ya que ésta última es influenciada por la ingesta dieté- tica de creatinina, la generación muscular, la secreción tubular mediante transportadores de cationes y aniones orgánicos y la eliminación digestiva extrarrenal. Estos factores son conocidos como “determinantes no-TFG”. Las ecuaciones que estiman la TFG son desarrolladas utilizando métodos de regresión logística en situaciones estables de Crs y con combinación de variables clínicas y demográficas que incluyen los “determinantes no-TFG”. Las ecuaciones que utilizan la Crs son más confiables comparadas con la determinación de la Crs sola.
La determinación analítica de creatinina se reali- za por dos métodos diferentes: los colorimétricos y los enzimáticos o cinéticos. Los métodos colorimétricos se basan en la reacción de la creatinina con el picrato alcalino en medio tamponado (reacción de Jaffé), previamente desproteinizado con ácido pícrico obteniéndose un cromógeno rojo que es medido por espectrometría a 510 nm.
Una variedad de sustancias presentes en plasma, denominados pseudocromógenos, tales como glucosa, proteínas, ácido ascórbico, cetoácidos, piruvato y ácido úrico reaccionan con el ácido pícrico ocasionando una sobreestimación de la concentración de creatinina. A su vez, concentraciones elevadas de bilirrubina, hemoglobina fetal y hemoglobina (presente en muestras hemolizadas) enmascaran el color desarrollado por la reacción ocasionando una infraestimación de su concentración. Los métodos enzimáticos presentan menos interferencias que los de Jaffé, aunque no están totalmente exentos de las mismas, particularmente, las debidas a concentraciones elevadas de bilirrubina.
Así, las fuentes de error en la estimación de la TFG a partir de la Crs incluyen 1) condiciones clínicas fuera de situaciones estables, 2) determinantes no-TFG de la Crs, 3) error de medición a altos valores de TFG y 4) interferencias analíticas en la medición de la Crs. La estimación de la TFG es menos precisa con valores altos de TGF respecto a valores bajos.
Se han desarrollado numerosas ecuaciones para estimar la TFG o ClCr en adultos basadas en la creatinina, sexo, edad, raza y superficie corporal como dato de producción endógena de creatinina. Las ecuaciones que poseen mayor exactitud son aquellas que fueron diseña- das utilizando determinaciones de Crs con trazabilidad respecto al método estándar de referencia internacional (espectometría de masas por dilución isotópica IDMS). De éstas, solo las ecuaciones MDRD (Modification of Diet in Renal Disease), la CKD-EPI (Chronic Kidney Disease Epidemiology Collaboration) y las modifica- ciones respectivas fueron diseñadas bajo dicha metodología. Las ecuaciones de Cockcroft – Gault y de otros autores fueron desarrolladas previamente a la existencia de determinaciones analíticas internacionales y no pue- den ser reformuladas las determinaciones de creatinina estandarizadas.
La ecuación de MDRD fue desarrollada por Levey y col. en el año 1999 como resultado de un análisis re- trospectivo del estudio “Modification of Diet in Renal Disease”, cuyos objetivos fueron mejorar la exactitud de la fórmula de CockcroftGault y estimar el filtrado glo- merular y no el clearance de creatinina.
Se desarrolló a partir de una población de 1070 individuos adultos, de ambos sexos, con predominio de raza blanca y afectos de enfermedad renal crónica (ERC) y se utilizó como medida del filtrado glomerular el clearance de 125Iiotalamato. La ecuación, conocida como MDRD6 es el resultado de un análisis de regresión múltiple en el que intervinieron seis variables (concentraciones séricas de urea, creatinina y albúmina, edad, sexo y raza). Un año después, el mismo grupo publicó una versión abreviada de la fórmula con cuatro variables (MDRD4) que no precisa de la concentración sérica de urea ni albúmina, manteniendo la misma eficacia diagnóstica que la fórmula original, pero de más fácil aplicación. Los laboratorios clínicos que utilicen métodos con trazabilidad respecto a IDMS deben utilizar la ecuación desarrollada a partir de la revaloración de la ecuación MDRD4 de- nominada MDRDIDMS; los laboratorios que utilicen métodos sin trazabilidad respecto al método de referencia deben utilizar la ecuación de MDRD4. La ecuación MDRD es actualmente recomendada por el NKDEP (National Kidney Disease Education Program) y por el Department of Health del Reino Unido para informar la TFG calculada utilizando Crs, sexo, edad y raza.
Sin embargo, debido
a la imprecisión para infor- mar altos valores
de TFG, el NKDEP recomienda que valores mayores a 60 ml/min/1,73m2 utilizando la ecuación MDRD, no sean informados de manera
cuantitativa. La ecuación CKD-EPI
fue desarrollada en el año 2009, utiliza las mismas cuatro variables de la ecuación MDRD y muestra menos sesgo (especialmente para va- lores altos de TFG) y mayor precisión.
La ecuación de Cockcroft-Gault fue publicada en 1976 y ha sido habitualmente utilizada en el ajuste de dosis de fármacos. Se desarrolló para valorar el clearance de creatinina a partir de una población de 236 individuos adultos, de edades comprendidas entre 18 y 92 años, mayoritariamente de sexo masculino y con un valor medio de aclaramiento de creatinina de 72,7 ml/min. Para la obtención de la ecuación se utilizó un análisis de regresión en el que intervinieron como variables la concentración sérica de creatinina, el aclaramiento de creatinina, la edad y el peso.
Existen ciertas
consideraciones a tener en cuenta con el uso de las ecuaciones en relación al valor del filtrado
glomerular.
1. Con valores de ClCr inferiores a 15 ml/min/1,73m2, las ecuaciones (en especial
la de Cockcroft y Gault)
sobreestiman el filtrado.
2. Presentan mayor exactitud diagnóstica para valores de filtrado glomerular entre 15 y 60 ml/min/1,73m2 (estadios ERC 3 y 4) en especial MDRD,
3. Con valores entre
60 y 90 ml/min/1,73m2, el comportamiento de las ecuaciones es variable en función del
tipo de población estudiada y del método de creatinina utilizado.
4. En la población
sana (filtrado glomerular igual o superior a 90 ml/min/1,73m2 y en pacientes con nefropatía diabética incipiente con
hiperfiltración, las ecuaciones infraestiman el valor real
del filtrado (en particular la MDRD).
5. Para cualquier valor
de filtrado glomerular, las ecuaciones MDRD y CKD-EPI son más precisas
que la ecuación Cockcroft-Gault.
Material y método
El diseño metodológico de este estudio es longitu- dinal y observacional.
Se estudiaron pacientes internados en unidad de terapia intensiva con estadía prevista mayor de 24 ho- ras y no hayan mostrado deterioro actual de la función renal ni antecedentes de insuficiencia renal aguda ni crónica.
Se incluyeron todos los pacientes en quienes se constató una hiperfiltración glomerular definida como un valor de clearance de creatinina obtenido por recolección de orina en 24 horas mayor a 139 ml/min/1,73 m2.
Los pacientes menores de 18 años, embarazadas y los que posean diagnóstico de potenciales causas de insuficiencia renal fueron excluidos.
En cada paciente se obtuvo a diario una muestra de sangre venosa obtenida
por punción de vena periférica y orina
de 24 horas obtenida por recolección de la misma en brocal.
El volumen de muestra era de 5 ml. para tubos de determinación analítica utilizando el mismo procedimiento diario que se realiza habitualmente en la unidad de terapia intensiva.
La tasa de filtración glomerular se obtuvo mediante el clearance de creatinina estimado por la siguiente fórmula:
VFG (ml/min)= Vo (ml/min) x [Sp]o (mg/ml)
[Sp]p (mg/ml)
V0: diuresis en orina de 24 horas, [Sp]o: concentración urinaria de creatinina y [Sp]p: concentración plasmática de creatinina.
El valor del clearance de creatinina mediante la fórmula MRDR4 se basa en la siguiente ecuación: TFG estimada = 186 x (creatinina)-1,154 x (edad)-0,203 x (0,742 si mujer) x (1,210 si es de raza negra)
El valor del clearance de creatinina mediante la fórmula MRDR6 se basará en la siguiente ecuación: TFG estimada = 141 x min (creatinina sérica/k,1) a x max (creatinina sérica/k, 1)-1.209 x 0,993edad x
1.018 (si es mujer) x 1.159 (si es de raza negra)
K: adquiere valor de 0,7 para mujeres y 0,9 para hombres; a: es -0,329 para mujeres y -0,411 para hombres; min: mínimo de creatinina/k o 1; max: máximo de creatinina/k o 1.
El protocolo fue sometido en consideración por el Comité de Docencia e Investigación Interdisciplinario del Hospital de Emergencias “Dr. Clemente Álvarez” (HECA).
El procesamiento de datos se realizó conforme a las variables involucradas utilizando el método ANOVA y el coeficiente de correlación de Spearman y de Pearson para los datos parámetrico y noparaméricos según corresponda o existan modificaciones inesperadas.
Resultados
Se reclutaron 31 pacientes con cifras de velocidad de filtración glomerular mayor a 140 ml/min. Se calcularon los valores mediante la utilización de las fórmulas CKD-EPI y MDRD obteniéndose los siguientes resultados:
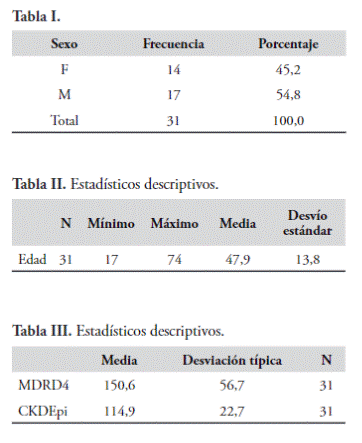
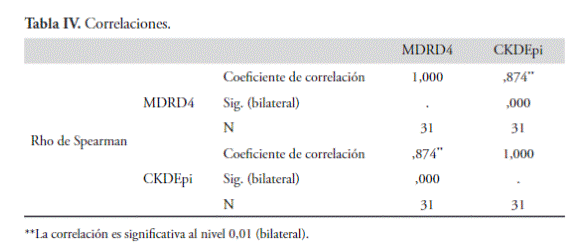
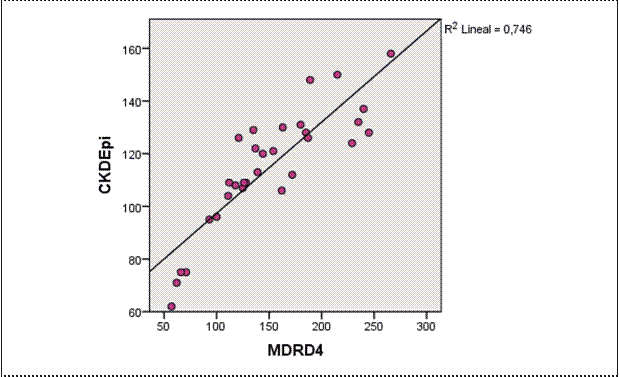
Figura 1.
El análisis inicial muestra una disparidad entre los valores calculados de la velocidad de filtración glomerular mediante orina de 24 horas con los valores estimados mediante la utilización de la fórmula CKD-EPI.
Más aún, se observa una falta de correlación positiva entre los valores encontrados utilizando las fórmulas CKD-EPI y la MDRD.
Del análisis comparativo de estas dos fórmulas se constata mejor correlación entre los valores obtenidos con la fórmula MDRD y el filtrado glomerular estimado por orina de 24 horas respecto a la relación de los datos obtenidos por la fórmula CKD-EPI con éste último.
Es importante considerar que la utilización de ecuaciones para estimar el filtrado glomerular encuentra varias limitaciones que deben ser siempre tenidas en cuenta. Una importante variable es que la concentración sérica de creatinina sea estable, motivo por el cual no deben ser utilizadas en el contexto de una enfermedad renal aguda, en fases de recuperación o en la exacerbación de una enfermedad renal crónica. En ciertas entidades clínicas, tales como malnutrición, vegetarianos, suplementación con creatina o creatinina, alteraciones importantes en la masa muscular (amputaciones, pérdida de masa muscular, enfermedades musculares, parálisis), índice de masa corporal inferior a 19 kg/m2 o superior a 35 kg/m2, hepatopatía grave, edema generalizado o ascitis, embarazo, evaluación de potenciales donantes de riñón y fármacos con eleva- da toxicidad y de eliminación por vía renal, el filtrado glomerular no debe ser estimado mediante el empleo de ecuaciones sino mediante el ClCr con orina de 24 horas o por la administración de algún marcador exógeno. Una última variable de importante trascendencia es la falta de estandarización de los métodos de medida de la creatinina y de los diferentes grados de inexactitud, imprecisión y susceptibilidad a interferencias de los mismos.
Hasta el día de la fecha, la estimación de la TFG en pacientes críticos y, particularmente en pacientes con riñón hiperfiltrante, no ha sido estimada con la ecuación CKD-EPI, ecuación que mostró mayor exactitud en pacientes con TFG disminuida.
En base a los datos obtenidos la estimación de la filtración glomerular en riñones hiperfiltrantes no podría ser estimada por fórmulas predictivas.
Discusión
La estimación de la tasa de filtración glomerular es un dato analítico de suma importancia en la práctica clínica diaria. La determinación más exacta hasta la fecha es mediante la recolección de orina de 24 horas. El incremento de los valores de dicha variable no se encuentra sistemáticamente establecido, a diferencia de la disminución de la misma, motivo que puede conducir a erróneas interpretaciones no solo en la fisiopatología del cuadro clínico sino a su correcto y oportuno tratamiento.
El tratamiento antibiótico, uso de drogas vasopresoras y drogas para sedación y analgesia son pilares trascendentales en el tratamiento de pacientes críticos, en especial en los politraumatizados y sépticos. La re- acción del organismo frente a una injuria severa es el desencadenamiento de una respuesta inflamatoria generalizada junto a intervenciones invasivas resulta en un cuadro particular que raramente es encontrado en otras situaciones clínicas. Frecuentemente, la disminución de la función de cualquier órgano en particular es de gran atención y centro de la terapéutica instituida. Sin embargo, el incremento de la performance de un órgano dado es habitualmente menos preocupante, basado en la idea que la hiperfunción tiene pocas probabilidades de generar reacciones adversas. No obstante el incremento de la TGF puede ocasionar serias alteraciones del perfil farmacocinético de drogas con eliminación principal- mente urinaria, entre los que se encuentran antibióticos
y otras drogas utilizadas a diario en UTI. El incremento de la dosis de antibiótico frente a hiperfiltración renal es, prácticamente, ausente en la literatura médica.
La trascendencia clínica de identificar pacientes con hiperfiltración glomerular con fórmulas predictivas es evaluar rápidamente concentraciones sub terapéuticas de drogas y corregir la dosis administrada para optimizar de esa manera el tratamiento instituido.
Conclusión
En base a los datos obtenidos, la estimación de la filtración glomerular en riñón hiperfiltrante no podría ser estimada con fórmulas predictivas.
La presencia del mismo hace impredecible la evolución de los pacientes críticos que requieran tratamiento (ej: antibiótico), por ello resulta fundamental la detección del fenómeno en forma temprana.
Sin embargo, en este grupo de pacientes, hasta el momento, no se realiza un ajuste de rutina de drogas a pesar de que el éxito del tratamiento dependa de ello.
Se necesitará un tamaño muestral
más grande debido a las dificultades procedimentales en la detección
de pacientes con hiperfiltración glomerular y el estudio de la farmacocinética de drogas utilizadas
habitualmente, a fin de establecer la influencia de la hiperfiltración glomerular en la concentración sérica de drogas,
ya que dicha variable
indudablemente influye no solo en la terapéutica
actual del paciente sino en su pronóstico.