Aumento de la capacidad diagnóstica de la ecografía (informada con clasificación t-rads) cuando se agrega una punción aspirativa con aguja fina (informada con sistema bethesda)
Increase of the diagnostic yield of thyroid sonogram (reported with t-rads clasification) when a fine needle aspiration cytology (reported with bethesda system) is added
STELLA MARIS BATALLÉS, OSCAR BRUNAS, JOSÉ LUIS NOVELLI*
Unidad de Tiroides del Grupo Oroño. Rosario, Argentina
Resumen
Cuando un nódulo tiroideo muestra características ecográficas sospechosas de malignidad (informada con clasificación T-RADS) casi no se discute que debe completarse el diagnóstico con una punción aspirativa con aguja fina (PAAF) (informada con sistema Bethesda). Pero cuando la ecografía sólo muestra características consideradas de benignidad, la indicación de PAAF es cuestionable y debe ser justificada. ¿Podrá la clasificación T-RADS determinar eficientemente cuáles nódulos tiroideos requieren una PAAF y cuáles no? Esta decisión está vinculada a determinar si un paciente deberá ser sometido o no a una cirugía tiroidea.
Objetivo: Analizar la capacidad de la clasificación T-RADS, con y sin el agregado de sistema Bethesda para optimizar el diagnóstico de patología tiroidea.
Material y métodos: se incluyeron 139 nódulos que requirieron cirugía, previamente evaluados con ecografía y con PAAF. Fueron realizadas por un mismo operador las ecografías (SMB), las punciones (OBM) y las cirugías (JLN). Se homogeneizaron las definiciones: T-RADS II-III-IVa y Bethesda II-III: Baja sospecha de malignidad; T-RADS IVb-V-VI y Bethesda IV-V-VI: Alta sospecha de malignidad.
Conslusiones: se comprobó que cuando las características ecográficas de un nódulo tienen baja sospecha de malignidad (T-RADS II-III-IVa), indicar una PAAF no aporta al diagnóstico en forma estadísticamente significativa. Cuando la ecografía indica alta sospecha de malignidad (T-RADS IVb-V-VI), la realización de una PAAF incrementa significativamente la certidumbre del diagnóstico.
Palabras claves: clasificación T-RADS, sistema
Bethesda, cirugía tiroidea, diagnóstico de cáncer
tiroideo.
Summary
When a thyroid nodule shows ultrasonographic characteristics of malignancy suspicion (informed with T-RADS classification), almost nobody discusses to complete diagnosis with a fine needle aspiration biopsy (FNAB) (informed with Bethesda system).
But when ultrasonography only shows characteristics compatible with benignity, a FNAB indication is questionable and that must be justified. Could T-RADS classification efficiently identify which nodule requires a FNAB and which does not? That decision will linked to which patients should be undergo a thyroid surgery.
Objective: to analyze T-RADS capability with and without Bethesda system to optimize the diagnosis of thyroid pathology. Material and methods: a total of 139 nodules which required surgery were included. They were previously evaluated with ultrasonography and FNAB. A same operator classified the T-RADS (SMB), the Bethesda system (OMB) and performed the surgeries (JLN).
For this work, definitions were homogenized as follows: T-RADS II-III-IVa and Bethesda II-III: Low suspicion of malignancy; T-RADS IVb-V-VI and Bethesda IV-V-VI: High suspicion of malignancy.
Conclusions: the evidence suggested that when a thyroid nodule shows low suspicion of malignancy by ultrasonography (T-RADS II-III-IVa), the indication of a FNAB did not add statistically significant diagnostic benefit.
When a thyroid nodule shows high suspicion of malignancy (T-RADS IVb-V-VI), a FNAB added significant diagnostic accuracy.
Key words: T-RADS classification, Bethesda system, thyroid surgery, thyroid cancer diagnosis.
Introducción
Los nódulos de tiroides son comunes en la población; estudios a gran escala han reportado una prevalencia de nódulos palpables del 5% en mujeres y del 1% en hombres en áreas yodo-suficientes.1 Los hallazgos ecográficos elevan esta prevalencia al 68%.2,3
La prevalencia de cáncer tiroideo es aproximadamente del 5% de los nódulos. Sin embargo, cuando los pacientes son seleccionados en base a características ecográficas, la prevalencia de malignidad asciende cercano al 13%.4-6
Para identificar los casos de malignidad basándose en las características ecográficas, se han propuesto varias estratificaciones de riesgo.
Horvath y cols (2009) propusieron el sistema de datos y reporte de imágenes en tiroides (T-RADS) tomando al sistema B-RADS como modelo de categorización de malignidad de los nódulos de mama7 (Figura 1). Las guías de la ATA, en su versión del año 2015 también estratificaron los riesgos de malignidad de los nódulos, y de acuerdo a ellos, las indicaciones para recomendar una punción con aguja fina (PAAF). El sistema de clasificación de riesgo de malignidad fue: alta, intermedia, baja, muy baja sospecha y benigno8. Estas Guías de ATA recomendaban que el informe de PAAF se interprete con la clasificación Bethesda9 (Figura 2).
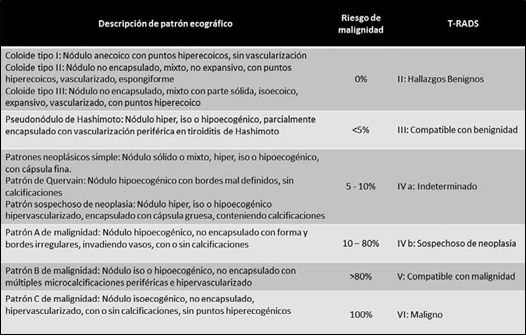
Figura 1. Patrones ecográficos de nódulos tiroideos y su correlación con malignidad histológica. Adaptación de Tabla 1 en: Horvath E, Majlis S, Rossi R, Franco C, Niedmann JP, Castro A, Dominguez M. An ultrasonogram reporting system for thyroid nodules stratifying cancer risk for clinical management. J Clin Endocrinol Metab. 2009;90(5):1748-51
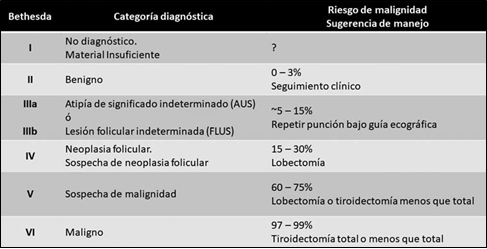
Figura 2. Clasificación citológica de sistema Bethesda.Adaptación de Figura 1 de: Baloch ZW, Alexander EK, Gharib H, Raab SS. Chapter 1. In: Ali SZ, Cibas ES, eds. The Bethesda System for Reporting Thyroid Cytopathology. New York, NY: Springer;2010:1–4.
Posteriormente, múltiples trabajos han mostrado variantes de la clasificación T-RADS para relacionarla con la clasificación de la ATA10 y con la clasificación Bethesda.11-14
Teniendo en cuenta que los nódulos tiroideos son frecuentes, mayormente benignos,y que muchosde ellos son sometidos a intervenciones innecesarias, también el Colegio Americano de Radiología (ACR) desarrolló un sistema de estratificación de riesgo T-RADS estandarizado. El mismo está basado en un léxico específico de descripción ecográfica, que identifica qué nódulos requieren una biopsia citológica (Figura 3).15
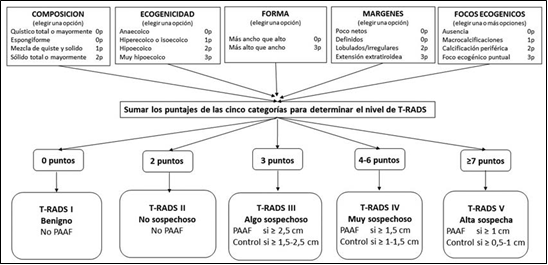
Figura 3.- Estratificación de riesgo T-RADS propuesto por el Colegio Americano de Radiología. Adaptación de American College of Radiologist. ACR TI-RADS Steering Committee. Disponible en: https:// www.acr.org/Clinical-Resources/Reporting-and-Data-Systems/TI-RADS(Consultadoel 24/04/2018).
La indicación apropiada de cuáles nódulos deberían punzarse y cuáles ser monitoreados es aún un tema de debate. Cuando un nódulo tiroideo muestra características ecográficas sospechosas de malignidad casi no se discute que debe completarse el diagnóstico con una PAAF. Pero cuando la ecografía muestra características consideradas de benignidad, la indicación de PAAF es cuestionable y debe ser justificada.
¿Podrá la clasificación T-RADS determinar eficientemente cuáles nódulos tiroideos requieren una PAAF y cuáles no? Esta decisión determinará qué paciente deberá ser controlado o sometido a una cirugía.
El objetivo de este trabajo fue analizar el aumento de la capacidad diagnóstica de la ecografía (informada con clasificación T-RADS) cuando se agrega una punción aspirativa con aguja fina (informada con sistema Bethesda).
Material y métodos
Estudio de tipo transversal, tendiente a evaluar, en un mismo nódulo, la concordancia entre dos sistemas de medición (T-RADS y Bethesda) y el diagnóstico histológico.
En el periodo Enero 2012 a Diciembre 2014 se evaluaron 150 pacientes consecutivos de un centro de cirugía de tiroides. Se trató de pacientes de ambos sexos, mayores de 18 años, que fueron tratados quirúrgicamente por una patología tiroidea nodular. Los pacientes fueron evaluados con eco Doppler tiroideo antes de la cirugía; las categorizaciones de T-RADS propuesta por Horvath y cols (2009) de todos los nódulos fueron realizadas por un mismo especialista en diagnóstico por imágenes (SMB). Los nódulos con características sospechosas fueron punzados; el informe citológico fue clasificado con el sistema Bethesda (OB) quien también realizó el estudio histológico de la pieza quirúrgica. Las cirugías fueron realizadas por un mismo cirujano (JLN).
De los 150 pacientes, se excluyeron los nódulos con T-RADS 1 (interpretado como ecografía normal) y Bethesda I (interpretado como material insuficiente para el análisis), los bocios tóxicos diagnosticados, otros tipos de carcinomas tiroideos o cuya cirugía fuere por recurrencia maligna. En los casos de bocios multinodulares se estudió el nódulo dominante. Conformaron el grupo en estudio 139 nódulos en 138 pacientes.
Análisis estadístico: Se realizó un análisis descriptivo para observar la distribución de las variables cuantitativas y cualitativas (edad, sexo, tipo de bocio, T-RADS, Bethesda, histología). Las variables cuantitativas seexpresaron como promedio ± desvío estándar, mediana y rango. Las variables cualitativas se definieron en términos porcentuales por categoría.
A los efectos comparativos de ambos métodos (T- RADS y Bethesda), se homogeneizaron las definiciones:
T-RADS II-III-IVa y Bethesda II-III:Baja sospecha de malignidad
T-RADS IVb-V-VI y Bethesda IV-V-VI: Alta sospecha de malignidad
La elección del punto de corte de T-RADS y Bethesda incluyó a los nódulos con <10% de malignidad y la indicación quirúrgica, según las respectivas clasificaciones.
Posteriormente se evaluó porcentualmente cuánta certidumbre agregaba al diagnóstico el hacer una PAAF en nódulos identificados en T-RADS con “alta sospecha de malignidad” y cuánta en nódulos identificados con “baja sospecha de malignidad”.
Todo el análisis estadístico fue realizado con el softwareIBM®-SPSS®V.21.Seestableciócomomargende error admisible en las pruebas estadísticas no mayor a 5%.
Resultados
Características de casos incluidos. Las características de los 138 pacientes y de los 139 nódulos incluidos se describen en la Tabla I. Se trató de un grupo mayoritariamente femenino, de 46 años de edad promedio; 3/4 bocios operados fueron multinodulares. El examen anátomo patológico identificó 51 nódulos con cáncer tiroideo y 88 con histología tiroidea benigna; en concomitancia con la patología benigna se identificaron 7 micro carcinomas que no fueron tenidos en cuenta para la clasificación maligna/benigna en este estudio, por ser hallazgos de la anatomía patológica diferida.
Capacidad diagnóstica de la ecografía (clasificada con T-RADS). La Tabla II muestra la capacidad diagnóstica de T-RADS. Se agruparon las categorías en alta y baja sospecha de malignidad antes definidos y se contrastaron con los resultados de la histología de la pieza quirúrgica (maligna/benigna).
De todos los cánceres, T-RADS clasificó con alta sospecha de malignidad a sólo al 47%: más de la mitad de los casos fueron F (-) (53%). La clasificación fue muy buena para sospechar benignidad: 75%, ya que la tasa de F (+) fue del 25%.
El 52.2% de los nódulos con alta sospecha de malignidad fueron cánceres y el 70.9% de los nódulos con baja sospecha de malignidad fueron efectivamente patología benigna.
Tabla I. Distribución de las variables evaluadas.
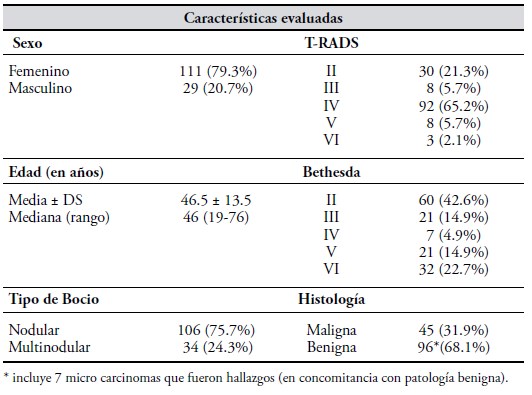
Tabla II. Evaluación
de la capacidad diagnóstica de la clasificación T-RADS.
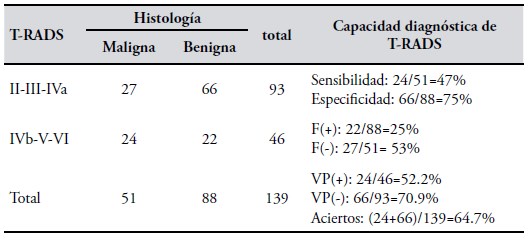
Tabla III. Evaluación de la capacidad diagnóstica de la clasificación Bethesda.
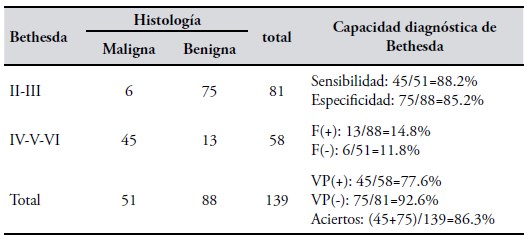
Capacidad diagnóstica de la PAAF (categorizada con sistema Bethesda). La Tabla III muestra la capacidad diagnóstica del sistema Bethesda. Se agruparon las categorías en alta y baja sospecha de malignidad antes definidas y se contrastaron con los resultados de la histología de la pieza quirúrgica (maligna/benigna).
En una muestra donde la prevalencia de cáncer fue del 36.7% (51/139), la clasificación Bethesda demostró una muy buena capacidad para sospechar malignidad: 88.2% y también para sospechar benignidad: 85.2%. Los aciertos de la clasificación Bethesda fueron del 86.3%. La clasificación informó falsamente un cáncer (F+) en el 14.8% de los nódulos, e informó falsamente una patología benigna (F-) en el 11.8% de los nódulos. Con un Bethesda con alta sospecha demalignidad, la probabilidad de que, efectivamente, el nódulo fuere un cáncer tiroideo fue del 77.6% Y si la citología informase baja sospecha de malignidad, la probabilidad que el nódulo fuere benigno fue del 92.6%.
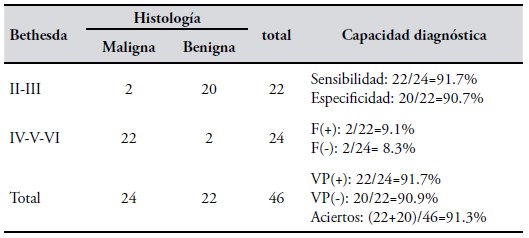
Ecografía + PAAF en nódulos con alta sospecha de malignidad. Si a los 46/139 nódulos que T-RADS identificó como alta sospecha de malignidad (IVb-V-
VI) se le hiciera una PAAF, ¿se mejoraría la capacidad diagnóstica? la Tabla IV muestra los resultados en este subgrupo de pacientes.
Se observó que el sistema Bethesda ratificó la alta sospecha de malignidad en 22/24 (91.7%) de los previamente así identificados con T-RADS.
Tabla IV.- Evaluación de la capacidad diagnóstica de la clasificaciónBethesda en nódulos que T-RADS identificó con alta sospecha de malignidad.
Ecografía + PAAF en nódulos con baja sospecha de malignidad. Si a los 93/139 nódulos que T-RADS identificó como baja sospecha de malignidad (II-III- IVa) se le hiciera una PAAF, ¿se mejoraría la capacidad diagnóstica? la Tabla V muestra los resultados en este subgrupo de pacientes.
Se observó que la clasificación Bethesda ratificó la baja sospecha de malignidad a 55/66 (83.3%) de los previamente así identificados con T-RADS.
Comparando la capacidad diagnóstica de la ecografía (Tabla III) y la obtenida con la PAAF conociendo lo que sospechaba la ecografía (Tablas IV y V),la evidencia sugirió que cuando un nódulo tiroideo tuvo alta sospecha de malignidad por ecografía, la adición de PAAF aumentó significativamente la certeza de ese diagnóstico (sensibilidad) del 47% al 91.7% (P=0.0002). La tasa de F (-) disminuyó considerablemente del 53% al 8.3% (P=0.0002). Aumentó la exactitud (del 64.7% al 91.3%, P=0.0005) con la misma prevalencia de cáncer (del 36.7% a 52.2%, P=0.06).
Tabla V.- Evaluación de la capacidad diagnóstica de la clasificación Bethesda en nódulos que T-RADS identificó con baja sospecha de malignidad.
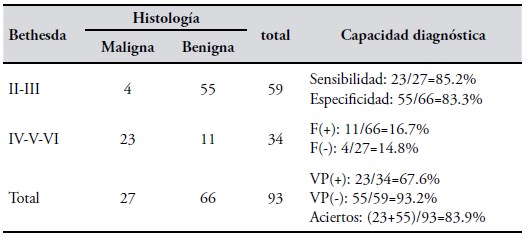
Por el contrario, cuando un nódulo tiroideo tuvo baja chances de malignidad por ecografía, el agregado de una PAAF no aportó al diagnóstico de manera estadísticamente significativa (especificidad) (del 75% vs 83.3%, P=0.21). No disminuyeron los F (+) (del 25% al 16.7%, P=0.202). Aumentó la concordancia (del 64.7% al 83.9%, P=0.0014), en similares valores de prevalencia de cáncer (del 36.7% al 29%, P=0.22).
Discusión
La clasificación T-RADS fue diseñada para ordenar las características ecográficas de los nódulos tiroideos acorde al riesgo de malignidad; ello permitiría seleccionar en forma eficiente los pacientes que requerirían una punción citológica; la intención de esa secuencia de pruebas es aumentar la certeza del diagnóstico: derivar al paciente a cirugía tiroidea o derivar a un control clínico.
Esta investigación cuantificó la utilidad del T- RADS para identificar a qué nódulos beneficiaría adicionar una PAAF. Cabe destacar que la prevalencia de cáncer tiroideo en este estudio fue elevada debido a que los pacientes incluidos tuvieron una patología nodular tiroidea que requirió una intervención quirúrgica.
Los aciertos de la clasificación T-RADS con la histología de la pieza quirúrgica fueron de casi el 65%. Esta clasificación identificó con baja sospecha de malignidad a tres de cada cuatro patologías benignas y reportó con baja sospecha de malignidad al 53% de los cánceres.
Otros autores han mostrado valores de sensibilidad más altos que los de esta experiencia (97.4% vs 47%) pero más bajos en especificidad (29.3% vs 75%), en VP (+) (23.3% vs 52.2%) y en precisión (42% vs 64.7%)10. Para nódulos no palpables y utilizando características ecográficas como referencia, para Kim y cols. (2002) la sensibilidad de la clasificación ecográfica fue del 94%, especificidad del 66%, VP (+) del 56%, negativo del 96% y acertaron en el 75% de los nódulos examinados.16
Conocida la óptima capacidad del material citológico para predecir malignidad o benignidad, algunos autores han tomado los resultados de la PAAF en vez de los datos patológicos para analizar la asociación con T-RADS con modelos de regresión logística y evaluar los OR de malignidad para cada categoría de T-RADS.17 Si bien es cierto que la PAAF tiene una muy buena capacidad diagnóstica, corresponde recordar que aun así, esta prueba admite errores; en nuestro trabajo estimamos casi un 15% de F (+) y casi un 12% de F (-).
Se han publicado meta-análisis que engloban los resultados de varios estudios y todos coinciden en que Bethesda es un efectivo sistema de clasificación de citologías para el tratamiento de nódulos tiroideos.14,18,19
La búsqueda de optimizar los dos métodos diagnósticos en patología tiroidea no es nueva. Estudios previos han evaluado las performances diagnósticas en conjunto de la ecografía y de citología, clasificando al nódulo en base a la presencia de diferentes patrones ecográficos de acuerdo al riesgo de malignidad y diseñando un algoritmo o árbol de decisión para la aplicación de distintas estrategias terapéuticas.20 Otros estudios hanutilizado el sistema de puntuación de acuerdo a las características ecográficas para seleccionar aquéllos en quiénes se sugiere indicar una PAAF (puntuación >5.4), aquéllos en quienes se desaconseja (puntuación <2.5) y cuáles quedan a criterio médico.21 Posteriormente otros estudios han ratificado esta metodología de construir puntajes ecográficos para predecir nódulos malignos y así reducir el número de PAAF innecesarias.22,23 Recientemente han comprobado la concordancia entre T-RADS y Bethesda con coeficientes de correlación, indicando que un nivel de T-RADS alto o bajo sugiere un riesgo alto o bajo de malignidad, lo que estaría asociado a una alta o baja probabilidad de malignidad en Bethesda.24
Este estudio contó con el beneficio de correlacionar los dos métodos diagnósticos con los resultados histológicos de la pieza quirúrgica. Esto pudo ser posible porque los datos provinieron de historias clínicas de pacientes ya operados. Así, se pudo determinar cuánto se gana en certidumbre diagnóstica hacer una PAAF cuando el T-RADS clasifica como nódulo con altas sospechas de malignidad y cuánto se gana en el caso de sospecha de benignidad.
Se deduce que la PAAF está indicada cuando las características ecográficas son sospechosas de malignidad. Esta prueba citológica no sólo mejora la capacidad de identificar los nódulos malignos, sino que reduce los errores de diagnóstico, aumentando la exactitud de los resultados.
Por el contrario, si las características ecográficas de un nódulo no son compatibles con malignidad, indicar una PAAF no mejoraría estadísticamente el diagnóstico. Este estudio adujo algunas desventajas metodológicas: no fue prospectivo y los resultados no fueron ajustados por variables que puedan afectarlos (sexo, edad, tipo de bocio)25. En nuestro estudio, la cantidad elevada de bocios multinodulares impidió identificar preoperatoriamente los hallazgos de micro carcinomas.
Conclusiones
El criterio de clasificación T-RADS tiene una muy buena capacidad diagnóstica de la naturaleza del nódulo tiroideo. El sistema Bethesda es aún más eficiente pero es un método más invasivo para el paciente.
Cuando la clasificación T-RADS sospecha malignidad en un nódulo tiroideo, se sugiere complementar el diagnóstico con una PAAF, porque permite aumentar la certidumbre del diagnóstico y decidir la conducta terapéutica.
Cuando la clasificación T-RADS sospecha benignidad en un nódulo tiroideo, éste resulta una metodología suficiente de evaluación.
Se requieren nuevos estudios para evaluar el costo de las discordancias entre la clasificación T-RADS y el sistema Bethesda.
Bibliografía
1. Yassa L, Cibas ES, Benson CB y cols. Long-term assessment of a multidisciplinary approach to thyroid nodule diagnostic evaluation. Cancer 111:508-516, 2007
2. Guth S, Theune U, Aberle J y col. Very high prevalence of thyroid nodules detected by high frequency (13 MHz) ultrasound examination. Eur J Clin Invest 39:699-706, 2009.
3. Gharib H, Papini E, Garber JR y col. AACE/ACE/AME Task Force on Thyroid Nodules. American Association of Clinical Endocrinologists, American College of Endocrinology, Associazione Medici Endocrinologi Medical Guidelines for Clinical Practice for the Diagnosis and management of Thyroid Nodules –2016 Update. Endocr Pract 2016;22:622-39, 2016.
4. Ezzat S, Sarti DA, Cain DR, Braunstein GD. Thyroid incidentalomas: prevalence by palpation and ultrasonography. Arch Intern Med 154:1838-1840,1994.
5. Papini E, Guglielmi R, Bianchini A y col. Risk of malignancy in nonpalpable thyroid nodules: predictive value of ultrasound and color-Doppler features. J Clin Endocrinol Metab 87:1941-1946, 2002.
6. Harach HR, Franssila KO, Wasenius VM. Occult papillary carcinoma of the thyroid: a normal finding in Finland—a systemic autopsy study. Cancer 56:531–538, 1985.
7. Horvath E, Majlis S, Rossi R y col. An ultrasonogram reporting system for thyroid nodules stratifying cancer risk for clinical management. J Clin Endocrinol Metab 90(5):1748-51, 2009.
8. Haugen BR, Alexander EK, Bible KC y col. 2015 American Thyroid Association Management Guidelines for Adult Patients with thyroid Nodules and Differentiated Thyroid Cancer: The American Thyroid Association Guidelines Task Force on Thyroid Nodules and Differentiated Thyroid Cancer. Thyroid 26 1-133, 2016.
9. Baloch ZW, Alexander EK, Gharib H, Raab SS. Chapter 1. En: SZ Ali y ES Cibas (eds) The Bethesda System for Reporting Thyroid Cytopathology Springer, New York, 2010.
10. Yoon JH, Lee HS, Kim E-K, Moon HJ, Kwak JY. Malignancy Risk Stratification of Thyroid Nodules: Comparison between the Thyroid Imaging Reporting and Data System and the 2014 American Thyroid Association Management Guidelines. Radiology 278:917-924, 2016.
11. Moon HJ, Kim EK, Kwak JY. Malignancy risk stratification in thyroid nodules with benign results on cytology: combination of thyroid imaging reporting and data system and Bethesda system. Ann Surg Oncol 21:1898-1903, 2014.
12. Moon HJ, Kim EK, Yoon JH, Kwak JY. Malignancy risk stratification in thyroid nodules with nondiagnostic results at cytologic examination: combination of thyroid imaging reporting and data system and the Bethesda system. Radiology 274:287-295, 2015.
13. Heller MT, Gilbert C, Ohori NP, Tublin ME. Correlation of Ultrasound Findings with the Bethesda Cytopathology Classification for Thyroid Nodule Fine-Needle Aspiration: A Primer for Radiologists. AJR 201:487-494, 2013.
14. Rahal Jr A, Falsarella PM, Rocha RD y col. Correlation of Thyroid Imaging Reporting and Data System [TI-RADS] and fine needle aspiration: experience in 1,000 nodules. Einstein 14:119-23, 2016. Disponible en: https://www. ncbi.nlm.nih.gov/pmc/articles/PMC4943343/
15. American College of Radiologist. ACR Ti-RADS Steering Committee. Disponible en: https://www.acr.org/Clini- cal-Resources/Reporting-and-Data-Systems/TI-RADS (Consultado el 24/04/2018)
16. Kim EK, Park CS, Chung WY y col. New Sonographic Criteria for Recommending Fine-Needle Aspiration Biopsy of Nonpalpable Solid Nodules of the Thyroid. AJR 178(3):687–691,2012.
17. Bongiovanni M, Spitale A, Faquin WC y col. The Bethesda System for Reporting Thyroid Cytopathology: A metaanalysis. Acta Cytol 56:333–339, 2012.
18. Hershman JM. The Bethesda System for Reporting Thyroid Cytopathology is effective for clinical management of thyroid nodules. Clin Thyroidol 2013;25:16–17.
19. Sheffield BS, Masoudi H, Walker B, Wiseman SM. Preoperative diagnosis of thyroid nodules using the Bethesda System for Reporting Thyroid Cytopathology: A comprehensive review and meta-analysis. Expert Rev Endocrinol Metab 9:97–110, 2014.
20. Adamczewski Z, Lewiński A. Proposed algorithm for management of patients with thyroid nodules/focal lesions, based on ultrasound (US) and fine-needle aspiration biopsy (FNAB); our own experience. Thyroid Res 6:6 , 2013.
21. Cavaliere A, Colella R, Puxeddu E y col. A useful ultrasound score to select thyroid nodules requiring fine needle aspiration in an iodine-deficient area. J Endocrinol Invest 32:440-444, 2009.
22. Petrone L, Mannucci E, De Feo ML y col. A simple ul trasound score for the identification of candidates for fine needle aspiration of thyroid nodules. J Endocrinol Invest 35:720–4, 2012.
23. Remonti LR, Kramer CK, Leitão CB y col. Thyroid ultrasound features and risk of carcinoma: a systematic review and meta-analysis of observational studies. Thyroid 25:538–50, 2015.
24. Vargas-Uricoechea H, Meza-Cabrera I, Herrera-Chaparro J. Concordance between the TIRADS ultrasound criteria and the BETHESDA cytology criteria on the nontoxic thyroid nodule. Thyroid Research 10:1, 2017.
25. Haut ER, Pronovost PJ. Surveillance bias in outcomes reporting. JAMA 305:2462–3,2011.