ARTÍCULOS ORIGINALES / ORIGINAL ARTICLES
Bacteriemia a Staphylococcus
aureus meticilino resistente
Methicillin resistant Staphylococcus aureus bacteremia
STEPHANIE DE ARAUJO OTERO1*, MARIANA LAGRUTTA1, LILIANA NEGRO MARQUÍNEZ1, ROBERTO PARODI1, JORGELINA PEREZ2, GABRIELA FALCO2, ALCIDES GRECA1
1 1ª Cátedra de Clínica Médica y Terapéutica, Facultad de Ciencias Médica, Universidad Nacional de Rosario, Argentina. Servicio de Clínica Médica, Hospital Provincial de Centenario, Rosario, Santa Fe, Argentina.
2 Servicio de Bacteriología, Hospital Provincial del Centenario, Rosario, Santa Fe, Argentina. Facultad de Ciencias Bioquímicas y Farmaceúticas, Universidad Nacional de Rosario.
Fecha de recepción: 30-09-19
Aceptado para su publicación: 20-11-19
Resumen
Introducción: La bacteriemia por Staphylococcus aureus meticilino resistente (SAMR) en una infección frecuente que representa un problema de salud pública creciente. El objetivo de este estudio es describir las características de las bacteriemias a SAMR y analizar los factores asociados con el origen de esta y su evolución. Material y métodos: Estudio descriptivo y analítico, retrospectivo; realizado entre 2014 y 2018 que incluyó pacientes con bacteriemia a SAMR hospitalizados en sala de clínica médica. Se clasificaron las bacteriemias por un lado según el origen de su adquisición en bacteriemia comunitaria, asociada a cuidados de la salud (ACS) e intrahospitalaria (IH).Por otro lado, según la sensibilidad del germen, se definió SAMR adquirido en la comunidad (SAMR-AC) versus SAMR adquirido en hospital (SAMR-AH). Resultados: Se incluyeron 56 episodios de bacteriemia a SAMR. El origen de la bacteriemia fue comunitaria en 41%, ACS en 32% e IH en 27%.La edad media fue de 43 (± 15) años, siendo menor en los casos comunitarios (p 0,027). El 83% eran de sexo masculino. Los factores de riesgo clásicos para adquisición de SAMR–AC se encontraron en un 56% de los casos con origen comunitario. El principal foco infectivo fueron los tejidos de piel y partes blandas (IPPB). Según la sensibilidad del germen, se aisló SAMR-AC en 88% y SAMR-AH en 12%.La demora hasta el inicio del tratamiento dirigido en el grupo comunitario fue 2,3 (± 2,2) días versus 0,9 (± 1,7) días en los otros (p 0,014). La bacteriemia fue complicada en el 64% delos episodios. La estadía hospitalaria fue de 29 (± 16) días. El 55% presentó falla clínica sistémica. La mortalidad fue del 7%. La edad y el foco neumónico se asociaron significativamente con mala evolución (p 0,04 y 0,015) y mortalidad (p 0,02 y 0,036). Conclusiones: Se sugiere mantener la sospecha de bacteriemia por SAMR ante infecciones originadas en la comunidad, aunque los factores de riesgo clásicos para resistencia se encuentren ausentes.
Palabras clave: Bacteriemia, Staphylococcus aureus meticilino resistente, Staphylococcus aureus meticilino resistente adquirido en la comunidad.
Abstract
Introduction: Methicillin resistant Staphylococcus aureus (MRSA) bacteremia is a common infection considered a growing public health issue. The aim of this study is to describe the characteristics of MRSA bacteremia and analyze the factors associated with its onset and evolution. Methods: A descriptive and analytical, retrospective study was conducted between 2014 and 2018 including hospitalized patients with MRSA bacteremia. This research involves community onset infections (CO), healthcare associated onset infections (HCA) and nosocomial onset infections (NO). Microbiologic classification was defined in MRSA community acquired (CA- MRSA) versus MRSA hospital acquired (HA-MRSA). Results: 56 episodes of MRSA bacteremia were included. The bacteremia onset was present in the community in 41% of the cases, health care associated in 32% and nosocomial in 27%. The average age was 43 (± 15) years, being the community cases present at younger ages (p 0.027). Out of the total, 83% were male patients. The typical risk factors for the acquisition of CA-MRSA were present in 56% of cases with community onset. The main source of infection was skin and soft tissues (SSTI). According to microbiologic classification, 88% was CA-MRSA and 12% HA-MRSA. The delay in the administration of targeted antibiotic treatment in the community group was 2.3 (± 2.2) days versus 0.9 (± 1.7) days in the others (p 0.014). Complicated bacteremia was present in 64%. Average hospital stay was 29 (± 16) days. Systemic clinical failure occurred in 55% of the cases. Mortality rate was 7%. Age and pneumonic focus were significantly associated with poor evolution (p 0.04 and 0.015) and mortality (p 0.02 and 0.036). Conclusions: We suggest to maintain the suspicion of MRSA bacteremia in community onset infections, although the common risk factors for resistance are absent.
Key words: Bacteremia, Methicillin resistant Staphylococcus aureus, Methicillin resistant Staphylococcus aureus community acquired.
Abreviaturas:
S. aureus: Staphyloccocus aureus.
SAMR: Staphyloccocus aureus meticilino resistente. SAMR comunitario: Staphyloccocus aureus meticilino resistente de origen comunitario según el origen de la infección.
SAMR –IH : Staphyloccocus aureus meticilino resistente intrahospitalario según el origen de la infección.
SAMR-AC: Staphyloccocus aureus meticilino resistente adquirido en la comunidad según sensibilidad microbiológica.
SAMR-AH: Staphyloccocus aureus meticilino resistente adquirido en el hospital según sensibilidad microbiológica. BSA: bacteriemia a Staphyloccocus aureus.
BSA-AC: bacteriemia a Staphyloccocus aureus adquirido en la comunidad.
BSA-ACS: bacteriemia a Staphyloccocus aureus asociada a cuidados de la salud.
BSA-IH: bacteriemia a Staphyloccocus aureus intrahospitalaria.
Grupo AC: grupo adquirido en la comunidad. Grupo ACS: grupo asociado a cuidados de la salud. Grupo IH: grupo adquirido en el hospital.
ATB: antibiótico.
ADVI/ADVE: adicto a drogas por vía inhalatoria /endovenosa.
IPPB: infección de piel y partes blandas. UTI: unidad de terapia intensiva.
IRC: insuficiencia renal crónica
CIM: concentración inhibitoria mínima
Introducción
Después de más de 120 años desde su descubrimiento, el Staphylococcus aureus (S.aureus) es considerado por la “Sociedad Americana de Enfermedades Infecciosas” (IDSA) como uno de los 6 microorganismos de mayor importancia en la práctica médica diaria, siendo una causa frecuente de infecciones en la comunidad y relacionadas con los cuidados médicos, así como, una de las principales causas de bacteriemias.1-4
La epidemiología de las bacteriemias por Staphylococcus aureus meticlino resistente (SAMR) se encuentra en constante cambio y representa un problema de salud pública con tasas de mortalidad tan elevadas como del 20 al 40%.1,3 Según el Centro de Control y Prevención de Enfermedades (CDC) en el año 2011, SAMR causó 80.461 infecciones invasivas y 11.285 muertes en los Estados Unidos (EEUU).5 En las últimas dos décadas se produjo un aumento dramático en la incidencia de bacteriemias a S. aureus y de las tasas de resistencia antibiótica.3 En Latinoamérica, Arias et al.5 hallaron que la proporción de SAMR sigue siendo alta en la región, por encima del 40% en la mayoría de los países.5-6 En el estudio de Egea et al.,7 realizado en Argentina durante el 2009, se observó una incidencia de SAMR del 55%.
Las infecciones por SAMR fueron en su inicio adquiridas en los hospitales (SAMR-AH), sin embargo, a finales de los años 90, se observó una emergencia de SAMR en infecciones de la comunidad (SAMR-AC). El SAMR-AC posee atributos específicos de virulencia: una exotoxina -la leucocidina de Panton-Valentine (PVL)- asociada con procesos inflamatorios severos en piel y partes blandas, así como a neumonía necrotizante, mayor rapidez de duplicación celular y una alta capacidad de diseminación. Se han identificado diferencias genéticas entre ambas cepas. Los genes de resistencia a meticilina de los SAMR-AC se encuentran en una región de reciente identificación (SCCmec IV o V), distinta a la que poseen los SAMR-AH clásicos, que no contienen los genes de resistencia a antibióticos adicionales.2,8-10 Por ese motivo las cepas difieren en su perfil de sensibilidad antibiótica. El número de infecciones de SAMR-AC parece ir en aumento,11 y las cepas responsables de estas infecciones, aparecen también en el entorno hospitalario, borrando la línea entre cepas de la “comunidad” y del “hospital”.10
La vancomicina y la daptomicina son los únicos agentes actualmente aprobados para el tratamiento de la bacteriemia a SAMR. Sin embargo, a pesar de ciertas limitaciones, la vancomicina continúa siendo el pilar del tratamiento, debido a sus costos relativamente bajos y resultados clínicos de no inferioridad.12,13
Muchos interrogantes claves para el diagnóstico y manejo clínico de las infecciones por SAMR continúan sin respuesta. Esto, enfatiza la necesidad de contar con nuevos estudios, que puedan contribuir a la toma de decisiones en cuanto al tratamiento óptimo de infecciones invasoras, y sobre estrategias de prevención y vigilancia epidemiológica.1
Objetivos del estudio
- Describir las características epidemiológicas, clínicas, bacteriológicas,
medidas terapéuticas y evolución de las bacteriemias a SAMR.
- Analizar los factores asociados con el origen y evolución de la bacteriemia a SAMR.
Material y métodos
Estudio descriptivo y analítico, observacional, retrospectivo, realizado entre el 01/01/2014 y el 31/10/2018; en la sala del servicio de Clínica Médica del Hospital Provincial del Centenario, en la ciudad de Rosario, Argentina. Incluyó pacientes mayores de 15 años, de ambos sexos, hospitalizados en la sala general del servicio de Clínica Médica, ingresados consecutivamente por cuadro de bacteriemia a SAMR con al menos un hemocultivo positivo tomados al ingreso al hospital o durante la internación. Se excluyeron pacientes con historias clínicas incompletas.
Se utilizó la base de datos del servicio de Clínica Médica y del servicio de Microbiología del Hospital Provincial del Centenario para la búsqueda inicial de casos, y se revisaron las historias clínicas completas de todos los pacientes incluidos. Se analizaron variables demográficas, antecedentes personales, comorbilidades, hallazgos físicos, analíticos, microbiológicos, tratamiento, días de internación y mortalidad.
Se definió SAMR-AC según la sensibilidad del germen: debido a que no disponemos en nuestro medio de pruebas genéticas. Se consideró que una cepa de S. aureus fue con gran probabilidad un SAMR-AC cuando en el antibiograma presentó resistencia a los betalactámicos y sensibilidad a múltiples clases de antibióticos (clindamicina, trimetoprima-sulfametoxazol, eritromicina, gentamicina, tetraciclina, rifampicina y ciprofloxacina).14 A su vez se definió según sensibilidad SAMR-AH a las cepas de S. aureus resistentes a la meticilina que son resistentes a 3 o más antibióticos no betalactámicos.14
En cuanto al origen de la adquisición de la bacteriemia, se definió bacteriemia a Staphyloccocus aureus adquirido en la comunidad (BSA-AC) cuando los hemocultivos fueron positivos dentro de las 48 horas de ingreso al hospital, y no encuadra en la definición de bacteriemia asociada a cuidados de salud. Bacteriemia a Staphyloccocus aureus asociada a cuidados de la salud (BSA-ACS) cuando la infección se diagnostica dentro de las 48 horas de admisión al hospital, en un paciente con un contacto extenso con los cuidados médicos, definido como: terapia endovenosa, curación de heridas o cuidados de enfermería especializados en el domicilio; residente de un asilo; hospitalización por 2 o más días en los 90 días previos; receptor de diálisis o receptor de terapia inmunosupresora. Y bacteriemia intrahospitalaria (BSA-IH) cuando los hemocultivos resultaron positivos después de 48 horas de internación.3,15
Se consideró racionalización al cambio a antibióticos de espectro más estrecho, según resultados de cultivos o mejoría del paciente.15,16
Se consideró falla clínica sistémica cuando el paciente presentaba alguno de los siguientes eventos: (1) muerte; (2) bacteriemia persistente; (3) recaída de bacteriemia; (4) sepsis y /o shock séptico y/o insuficiencia respiratoria aguda durante la internación.16,17 Se consideró falla clínica severa cuando presentó alguno de los siguientes: (1) muerte y (2) sepsis, shock séptico y/o insuficiencia respiratoria aguda durante la internación.
Para el análisis estadístico de las variables estudiadas se utilizó el programa IBM SPSS Statistics versión 19. Los datos se expresan como porcentajes (n), o como media ± desvío estándar. La significancia de lasdiferencias correspondientes a las variables cuantitativas se estimó mediante la prueba de la t de Student. Las diferencias correspondientes a las variables cualitativas se estimaron mediante la prueba de Chi cuadrado o la prueba de significancia exacta de Fisher. Se consideró diferencia estadísticamente significativa cuando el valor de “p” era inferior a 0,05.
Resultados
Se incluyeron 48 pacientes, los cuales presentaron 56 episodios de bacteriemia a SAMR. Ocho pacientes fueron reingresados en el hospital. La edad media fue de 43 (± 15) años y el 83% eran varones.
El 77% presentaban comorbilidades, siendo las más frecuentes IRC (40% en diálisis) y DBT (Gráfico I).
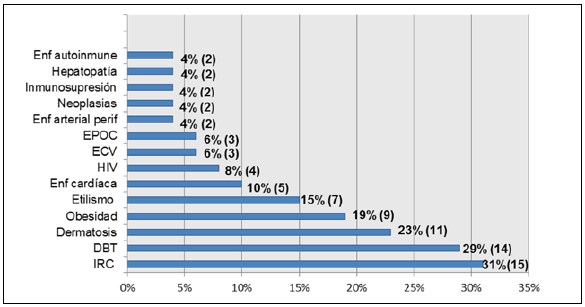
Gráfico I. Comorbilidades.
HIV: infección por virus de la inmunodeficicencia humana; ECV: enfermedad cerebrovascular; EPOC: enfermedad pulmonar obstructiva crónica; DBT: diabetes; IRC: insuficiencia renal crónica.
Los factores de riesgo clásicamente descriptos para adquisición de BSA se hallaron presentes en 80% de los casos, destacándose como los más importantes el uso previo de ATB, la presencia de DBT, etilismo y adicción a drogas por vía inhalatoria/endovenosa (ADVI/ADVE) (Tabla I).
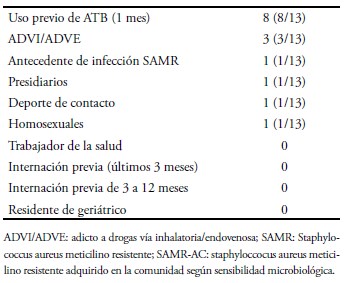
Los factores de riesgo específicos para adquisición de SAMR–AC se encontraron en un 56% (13/23) de los casos con origen de la bacteriemia en la comunidad. De ellos, el principal factor de riesgo fue el uso previo de antibióticos, siendo los betalactámicos los más frecuentemente indicados. El motivo de la indicación de ATB fueron infecciones de piel y partes blandas (IPPB), neumonía y sífilis (Tabla II).
Tabla I. Factores de riesgo BSA.
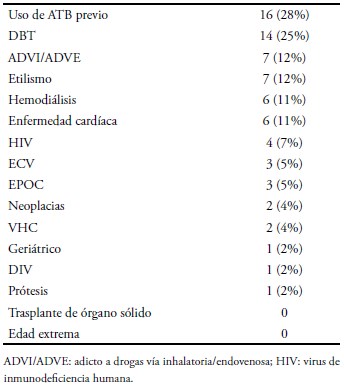
Tabla II. Factores de riesgo SAMR-AC.
Los factores de riesgo para SAMR-AH se hallaron en el 64% (21/33) de los casos con bacteriemia asociada a los cuidados de la salud y nosocomial. La hospitalización y hemodiálisis fueron los principales factores predisponentes (Tabla III).
Tabla III. Factores de riesgo SAMR-AH.

En cuanto al origen de la adquisición de la bacteriemia, fue de origen comunitario (BSA-AC) en 41% (n23) de los casos, asociada a cuidados de la salud (BSA- ACS) en 32% (n 18) e intrahospitalaria (BSA-IH) en 27% (n 15).
Se observó una edad media de presentación de 37,9 (±14,6) años en las bacteriemias adquiridas en la comunidad versus 46,7 (±13,9) años en las otras (p=0,027). El promedio del Score de Charlson fue de 0,22 (±0,42) en los pacientes con infección de la comunidad versus 2,09 (±1,5) en los otros grupos (p<0,001).
El principal foco infectivo fueron los tejidos de piel y partes blandas en 48% (n 27) de los episodios. De estos el 63% (17/27) fueron lesiones abscedadas (Gráfico II). Se observa un 83% (19/23) de IPPB en el grupo adquiridas en la comunidad versus 24% (8/33) en los otros grupos (p<0,001) (Tabla IV).
Tabla IV. Foco
infectivo según el origen de la bacteriema.
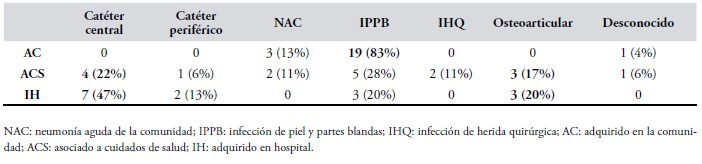

Gráfico II. Foco infectivo.
IPPB: Infección de piel y partes blandas; NAC: neumonía aguda de la comunidad; Inf: infección; Qx: quirúrgica.
Del total de los casos de bacteriemia se aisló según sensibilidad antibiótica SAMR-AC en 88% (n 49) y SAMR-AH en 12% (n 7).
El SAMR-AC fue el causal del 96% (22/23) de las BSA-AC, 78%(14/18) de las BSA-ACS y 87% (13/15)
de las BSA-IH. El SAMR-AH produjo el 4% (1/23) de las BSA-AC, el 22% (4/18) de las BSA-ACS y el 13% (2/15) de las BSA–IH.
La edad media en pacientes con SAMR-AC fue de 41,41(±14,71) años versus 55,29 (±8,79) años en pacientes con SAMR-AH (p=0,004). El promedio del Score de Charlson fue de 1,14 (±1,44) en los pacientes con SAMR-AC versus 2,57 (±1,71) en SAMR-AH (p=0,020).
La resistencia antibiótica según el origen de la bacteriemia se presenta en la tabla V.
La concentración inhibitoria mínima (CIM) de la vancomicina fue realizada en 78% de los casos (n 44) con un promedio de 1. La vancocinemia se solicitó en 23% (n 13) de los casos, de los cuales 9 presentaron falla clínica y 4 bacteriemia complicada.
Se solicitaron cultivos de otras muestras asociados al cuadro clínico (Tabla VI).
Tabla V: Resistencia SAMR en hemocultivos según
origen de bacteriemia.

Tabla VI. Aislamiento en otras muestras.

El tratamiento empírico adecuado se instauró en el 62% (n 35) de los casos. El 45% (n 25) de los pacientes requirieron cambio del tratamiento inicial. El motivo del cambio fue por ajuste al antibiograma en 76% (19/25) de los casos y por falta de respuesta en un 24% (6/25). En los pacientes en que el tratamiento empírico inicial fue inadecuado el Score de Charlson fue de 0,5 (±1,12), mientras que en aquellos con elección adecuada el score fue de 1,7 (±1,5) (p=0,004). Además, en el primer grupo se constató más frecuentemente fiebre persistente 61,5% (8/13) versus 38,5%(5/13) con una p de 0,041; y una tendencia a internaciones más prolongadas, 33,2 (± 16,9) días versus 26,7 (±16,2) días (p = 0,15).
El tratamiento dirigido adecuado se realizó en el 91% (n 51) de los casos, siendo el período hasta su instalación de 2,3 (± 2,2) días promedio en el grupo AC; de 1,1 (± 1,46) días en el grupo ACS y de 0,7 (± 2) días en IH. Se comparó la demora en el grupo de adquisición comunitaria versus los otros grupos, obteniendo una media de 2,3 (± 2,2) días vs 0,9 (± 1,7) días con una diferencia estadísticamente significativa (p=0,014).
El tratamiento elegido fue monoterapia con vancomicina en un 41% (n 23) y un esquema combinado en el 59% (n 33), de los cuales en un 45% (15/33) se asoció un betalactámico.
La duración total del tratamiento antibiótico por vía endovenosa fue de 20,6 (±13) días promedio.
Se realizó racionalización antibiótica en el 55% de los casos. El antibiótico más utilizado para ello fue trimetropima/sulfametozaxol en un 50% (15/30).
Los pacientes presentaron factores de riesgo para desarrollar complicaciones en el 41% (n 23). Entre los más frecuentes se detectaron: adquisición de la infección en la comunidad en 41% (n 23), fiebre persistente en 23% (n 13) y bacteriemia persistente en 18% (n 10).
En el 93% de los casos se tomaron hemocultivos de control. Se realizó ecocardiograma transtorácico a 47 pacientes (84%). De estos el 68% (32/47) presentaba bacteriemia complicada. Mientras que a 13 pacientes (23%) se les realizó ecocardiograma transesofágico. Sólo se diagnosticó endocarditis infecciosa en 1 caso.
La bacteriemia fue complicada en 64% (n 36) de los casos, no encontrándose asociación ni con el origen de la bacteriemia (p=0,2), ni con el tratamiento empírico adecuado (p= 0,15) (Gráfico III).
Dentro de las infecciones a distancia, el más frecuente fue el compromiso a nivel osteomioarticular en 58% (19/33), seguido por embolias pulmonares en 45% (15/33), afección genitourinaria 13% (4/33), del sistema nervioso central 9% (3/33), ocular 6% (2/33) y mediastino en 3% (1/33). La principal complicación fue la presencia de un foco no drenado en 54% (n 30), de los cuales el 93% (28/30) fue sometido a desbridamiento quirúrgico.

Gráfico III: Bacteriemia complicada.
El promedio de internación fue de 29 (± 16) días. El 29% (n 16) de los pacientes requirió internación en UTI.
En cuanto a la evolución el 34% (n 19) de los pacientes presentaron signos de sepsis durante algún momento de la internación. El 55% (n 31) presentó falla clínica sistémica: muerte 7% (n 4), bacteriemia persistente 18% (n 10), recaída de la bacteriemia 14% (n 8), sepsis, shock séptico y/o insuficiencia respiratoria aguda 34% (n 19). La edad se asoció con falla clínica sistémica, así la edad media en pacientes con falla clínica fue de 46,7 (±15) años, mientras que en paciente sin falla clínica fue de 38,7 (±13,3) años con p=0,04.
La neumonía como foco infeccioso primario resultó predictor de mala evolución, ya que en el 80% (4/5) se constató falla clínica severa versus 21,6% (11/51) en otros focos (p=0,015).
En el grupo tratado con vancomicina hubo 40% (9/23) de falla clínica y 60% (22/33) en el grupo con tratamiento combinado (p=0,008). También, observamos que los pacientes con tratamiento combinado presentaron más bacteriemia complicada. Se destaca una mayor recaída de la bacteriemia en pacientes tratados con monoterapia con 75% (6/8) versus 25%(2/8) en pacientes con tratamiento combinado. No encontramos asociación entre la CIM de vancomicina y falla clínica.
En el 14% (n 8) de los casos hubo recaída. El foco infectivo de catéter central se asoció a mayor tasa de recaída con 45% (5/11) (p=0,001).
La mortalidad fue del 7% (4/56). La edad medio de los pacientes fallecidos fue de 59,7 (± 5,7) años versus 41,8 (± 14,5) años en sobrevivientes (p=0,002). Hubo una tendencia a mayor score de Charlson en pacientes con evolución fatal 2,75 (± 0,9) versus sobrevivientes 1,21(± 1,5) (p=0,053). Fallecieron 2 de 5 pacientes con foco neumónico versus 2 de 51 con otros focos infecciosos, diferencia con significación estadística (p=0,036).
Discusión
En este estudio se evidenció un franco predominio de las infecciones por SAMR en el sexo masculino coincidiendo con los hallazgos en la bibliografía,7,11,15,18 si bien la causa de esta diferencia es desconocida. La edad promedio de presentación fue de 43 años, similar al estudio de Egea et al.,7 aunque difiere con el resto de la bibliografía donde estás infecciones predominan en las edades extremas de la vida.11,15,19,20
Las principales comorbilidades fueron la insuficiencia renal crónica y la diabetes al igual que en otros estudios.15,19,21,22 Sin embargo, el promedio del score de Charlson fue bajo, en particular en los pacientes con infecciones de la comunidad.
Un gran porcentaje de los pacientes presentaron factores de riesgo para adquisición de BSA, siendo los principales: el uso de antibióticos previos, diabetes, etilismo y ADVI/ADVE, coincidiendo con lo hallado en otros trabajos.3,11,15,19 No obstante, en los estudios citados, se remarca la fuerte asociación de la bacteriemia con la infección por HIV11 y con el requerimiento de hemodiálisis,3,11 lo cual no coindice con nuestros hallazgos. Los factores de riesgo para adquirir SAMR-AH se observaron en un gran porcentaje de los casos. En cuanto a SAMR-AC, casi la mitad no presentaba ningún factor de riesgo, prevaleciendo en personas jóvenes y sin comorbilidades, coincidiendo con la bibliografía.7,14,15,23,24 La adquisición de la BSA-AC fue la más frecuente, seguida en orden por la asociada a cuidados de la salud e intrahospitalaria. Esto concuerda con el trabajo de Egea et al (7) donde se observa una prevalencia del 61%, 52% y 49%, respectivamente. En cambio, en estudios de origen europeo y norteamericano, se informan frecuencias inversas del sitio de adquisición de la infección.3,7,15,21,24,25
El principal foco infectivo fueron las IPPB. Se observó un claro predominio de las IPPB en las infecciones comunitarias, en cambio en el grupo ACS-IH, el foco predominante provino de infecciones relacionadas a catéteres y osteoarticulares, en semejanza con la bibliografía.7,11,14,19
Los resultados obtenidos mostraron que la mayoría de los aislamientos de SAMR se clasificaron como SAMR-AC, basado en la sensibilidad del germen. Éste fue el causal de casi la totalidad de las infecciones comunitarias, y de un muy alto porcentaje de las infecciones asociadas a cuidados a salud y nosocomiales, coincidiendo con algunos trabajos.7 Este hallazgo es para destacar y sugiere fuertemente, que en nuestro medio los típicos linajes de SAMR-AC parecen estar reemplazando a los clones de SAMR-AH clásicos como causas de infecciones nosocomiales.
Las bacteriemias de origen comunitario se asociaron con tasas mucho más bajas de resistencia a clindamicina y eritromicina en comparación con ACS e IH, además no presentaron resistencia a ciprofloxacina. Estos resultados son similares a los descripto en los trabajos de Egea et al.7 y Arias et al.5 Observamos un alto rédito de cultivos de piel y partes blandas, osteoarticulares y retrohemocultivos/punta de catéter con frecuencias similares a otros reportes;16,26,27 mientras que el rédito de los urocultivos fue bajo.
El tratamiento empírico adecuado se indicó en más de la mitad de los pacientes. Los pacientes con tratamiento empírico inadecuado presentaron un score de Charlson más bajo. Este hallazgo discrepa con el trabajo de Kim et al.,28 donde estos pacientes presentaban enfermedades subyacentes graves. También observamos que la elección de un tratamiento empírico inadecuado se asoció con fiebre persistente y una tendencia a internaciones más prolongadas. La demora hasta la instauración del tratamiento antibiótico adecuado fue mayor en el grupo de infecciones comunitarias, en comparación con los otros grupos (ACS-IH). Una explicación posible para este hallazgo, podría ser, que en los casos de origen comunitario no suele sospecharse inicialmente infecciones invasivas por SAMR. Casi la mitad de los pacientes requirieron cambio en el tratamiento antibiótico inicial, predominantemente en el grupo de la comunidad, lo cual coincide con el trabajo de Klevens.24 El principal motivo del cambio de antibióticos, fue el ajuste según susceptibilidad del germen. La duración total del tratamiento fue de 20,3 días sin diferencias en infecciones AC, ACS o IH. En la mitad de los casos se realizó racionalización antibiótica, cifra más alta comparada con otros estudios.15,25
En casi la mitad de los casos se detectaron factores de riesgo para el desarrollo de complicaciones, siendo el más frecuente la adquisición comunitaria de la infección. En nuestra investigación un alto porcentaje de los pacientes desarrollaron bacteriemia complicada, cifra notablemente mayor comparada con el trabajo de Fowler et al.29 Destacamos, por un lado, la alta frecuencia de infecciones a distancia, principalmente osteoarticulares y pulmonares, en comparación con otros trabajos,30-32 y por otro lado, la baja prevalencia de endocarditis infecciosa.33 Nuestro hospital cuenta con un centro de hemodiálisis que recibe derivación de una amplia población, siendo bien conocida la mayor frecuencia de bacteriemia, asociado a factores de inmunodepresión y al uso frecuente de catéteres venosos centrales en estos pacientes.11 Además presentan un mayor riesgo de recaídas, debido a la dificultad de mantener niveles adecuados de los antimicrobianos en sangre, con mayor riesgo de bacteriemia persistente y complicaciones.3,11
Más de la mitad de los pacientes presentaron un foco no drenado, siendo la principal complicación y coincidiendo con el trabajo de Fowler et al.29 En casi la totalidad de los casos se indicó drenaje o desbridamiento quirúrgico, con un porcentaje mucho mayor comparado con otros estudios.15
El promedio de días de internación fue de 29 días sin diferencias según el origen de la bacteriemia.
En nuestro trabajo más de la mitad de los pacientes presentó falla clínica sistémica, asociándose su desarrollo con la edad. En múltiples trabajos, la edad se relacionó con mortalidad precoz y tardía.11,15,18,19,25
No pudimos demostrar asociación entre el score de Charlson y el desarrollo de falla clínica sistémica. Existe discrepancia en varios estudios donde se compararon comorbilidades y mortalidad.15,18,19,25,34-36 En nuestro estudio observamos una proporción no despreciable de pacientes jóvenes sin antecedentes patológicos, es decir, con score de Charlson bajo, provenientes de la comunidad con BSA severas.
Tampoco hallamos relación entre origen de la bacteriemia y peor evolución. Esto concuerda con varios estudios de cohorte.37-39
El hallazgo de una peor evolución, en pacientes con foco neumónico inicial, concuerda con varios estudios.15,18,19,25,40-42
No encontramos asociación entre la instauración del tratamiento empírico adecuado y la presencia de falla clínica sistémica; asimismo, la demora en la instauración del tratamiento adecuado no se asoció con peor evolución de los pacientes. En el trabajo de Kim et al.28 se observó que el retraso en el inicio del tratamiento tuvo un impacto marginal en los resultados y no se asoció con mortalidad.
La CIM para vancomicina en nuestro estudio fue baja y no se asoció con el desarrollo de falla clínica ni microbiológica, coincidiendo con la literatura.29,48-50
El tratamiento antibiótico combinado fue el más frecuentemente utilizado, y se asoció a peor evolución, comparado con la monoterapia con vancomicina. En los diferentes estudios los resultados con respecto al tratamiento son heterogéneos.15,17,43 Debemos ser cautelosos con la interpretación de estos resultados, ya que en la mayoría de los casos el tratamiento combinado fue indicado para ampliar el espectro antibacteriano o para aumentar la actividad bactericida sinérgica, en aquellas infecciones consideradas clínicamente más graves y probablemente con mayor riesgo.
La falla microbiológica fue también mayor en los pacientes tratados con terapia combinada. Truong,43 si bien sostiene que la terapia combinada tiene mejores resultados clínicos, también encontró mayor tasa de falla microbiológica con este tratamiento. Este resultado podría justificarse, por las diferencias entre los factores de riesgo presentes en aquellos pacientes que recibieron tratamiento combinado comparado con la monoterapia, como por ejemplo, la presencia más frecuente de foco no drenado o de foco infectivo de mayor riesgo.
En nuestro estudio, la recaída estuvo asociada al origen ACS-IH y al foco infectivo primario por catéter central, lo cual no concuerda con el trabajo de Welsh.51 El tratamiento con vancomicina se relacionó con mayores tasas de recaída en nuestro trabajo, mientras que no encontramos asociación entre la duración total del tratamiento antibiótico y las tasas de recaídas, ambos hallazgos coincidentes con la literatura.51
La mortalidad en nuestro trabajo fue relativamente baja, 7% (4/56), comparada con otros estudios donde se reportaron cifras entre el 20% y el 30%.15,19,22,24 La edad fue predictora de mortalidad, coincidiendo con la bibliografía.15,18,25 Encontramos una tendencia sin alcanzar significación estadística, entre el score de Charlson y la mortalidad, tal como está descripto en varios estudios.44-47 Como dato a destacar observamos que todos los pacientes fallecidos tenían una BSA–ACS, coincidiendo con el trabajo de Klevens.24 Remarcamos al foco neumónico como importante predictor de mortalidad, mientras que la IPPB se asocian a una mortalidad baja, coincidente con la literatura.15,18,19,22,25,40-42 Por último, encontramos que el SAMR–AH presentó tasas más altas de mortalidad en comparación con el SAMR-AC, coincidiendo con el trabajo de Egea et al.7 Esto puede deberse en parte a que los pacientes con infecciones por SAMR-AH eran más añosos y presentaban más comorbilidades con respecto al resto.
Conclusiones
Observamos en este estudio de bacteriemias a Staphylococcus aureus meticilino resistente, que el origen comunitario de la infección fue el más frecuente. Casi la mitad de los casos no presentaban factores de riesgo clásicos para SAMR-A. Predominó en varones jóvenes sin comorbilidades, con IPPB.
Informamos una alta prevalencia de SAMR-AC, tanto infecciones comunitarias como intrahospitalarias. Estas infecciones suelen ser invasivas, asociándose a elevada proporción de complicaciones y a una prolongada estadía hospitalaria. En nuestro trabajo evidenciamos que la mitad de los pacientes presentó falla clínica sistémica, siendo la edad, el foco infectivo neumónico y el tratamiento combinado predictores de mala evolución.
La mortalidad fue baja comparada con otras series. La edad y el foco infectivo neumónico fueron predictores de mortalidad, mientras que el score de Charlson mostró una tendencia en límite de significancia estadística.
En nuestro medio no se detectó resistencia a la vancomicina por lo que podemos continuar utilizándola como droga de primera línea, aunque en los casos con evolución tórpida se debe considerar el uso de otros antimicrobianos.
Finalmente, se sugiere mantener la sospecha de bacteriemia por SAMR ante infecciones originadas en la comunidad, aunque los factores de riesgo clásicos para resistencia se encuentren ausentes.
Bibliografía
1. Ardura M. Staphylococcus aureus: Vieja bacteria con nuevos trucos. Rev Chil Infect; 26 : 401-405,2009.
2. Álvarez I, Ponce Bittar J; Staphylococcus aureus, evolución de un viejo patógeno. Rev Cubana de Pediatría; 84: 383-391,2012.
3. Arroyave Rivera S, Atehortúa Barragán D, Jaimes Barragán
F. Actualización en Bacteriemia por Staphylococcus Aureus. MEDICINA U.P.B. 33: 48-55, 2014.
4. Naber CK, Baddour L ,Giamarellos-Bourboulis E y col. Clinical Consensus Conference: Survey on Gram- Positive Bloodstream Infections with a Focus on Staphylococcus aureus. Clin Infect Dis15;48 S260-70, 2009.
5. Arias C, Reyes J, Carvajal L y col. Molecular Epidemiology and Phylogenomics of Staphylococcus aureus Bacteremia in Latin-America: A Prospective Cohort Multicenter Study in Nine Countries. Antimicrob Agents Chemother. 61 (10) e00816-17; DOI: https://doi.org/10.1128/AAC.00816-17 , 2017.
6. Ribeiro A, Dias C, Silva-Carvalho MC y col. First Report of Infection with Community-Acquired Methicillin- Resistant Staphylococcus aureus in South America .J Clin Microbiol43:1985–1988, 2005.
7. Egea AL, Gagettib P, Lamberghinic R y col. New patterns of methicillin-resistant Staphylococcus aureus (MRSA) clones, community-associated MRSA genotypes behave like healthcare-associated MRSA genotypes within hospitals, Argentina. International Journal of Medical Microbiology.304:1086–1099, 2014.
8. Stryjewski M, Ralph Corey G. Methicillin-Resistant Staphylococcus aureus: An Evolving Pathogen. Clin Infect Dis 58: (Suppl 1):S10-9, 2014.
9. Sanabria G. Evolución de la resistencia en el Staphylococcus aureus. Rev Inst Med Trop Vol 3: 27-39, 2014.
10. Gordon RJ, Lowy FD. Pathogenesis of Methicillin-Resistant Staphylococcus aureus Infection. Clin Infect Dis.46 (Suppl 5): S350–S359, 2008.
11.Tong SY, Davis JS, Eichenberger E y col. Staphylococcus aureus Infections: Epidemiology, Pathophysiology,ClinicalManifestations, and Management. Clin Microbiol Rev 28:603-61, 2015.
12. Ortwine JK , Bhavan K. Morbidity, mortality, and management of methicillin-resistant S. aureus bacteremia in the US: update on antibacterial choices and understanding, Hospital Practice, 46:74-2, 2018.
13. Gudiol C, Cuervo G, Shaw E, Pujol M, Carratalà J. Pharmacotherapeutic options for treating Staphylococcus aureus bacteremia. Expert Opin Pharmacother 18:1947- 1963, 2017.
14. Loewen K, Schreiber Y, Kirlew M y col. Community- associated methicillin-resistant Staphylococcus aureus infection. Literature review and clinical update. Can Fam Physician. 63:512-520, 2017.
15. Bassetti M, Peghin M, Trecarichi EM y col. Characteristics of Staphylococcus aureus Bacteremia and Predictors of Early and Late Mortality. PLoS ONE Feb 2;12(2):e0170236. DOI: https://doi.org/10.1371/journal.pone.0170236. 2017.
16. Garau J, Ostermann H, Medina J y col.Current management of patients hospitalized with complicated skin and soft tissue infections across Europe (2010– 2011): assessment of clinical practice patternsand real-life effectiveness of antibiotics from the REACH study .Clin Microbiol Infect ; 19: E377–E385,2013.
17. Casapao AM, Jacobs DM, Bowers DR y col. Early administration of adjuvant b-lactamic therapy in combination with vancomicyn among patients with meticilin resistant Staphylococcus aureus bloodstream infections: a retrospective, multicenter analysis. Pharmacotherapy 37:1347-1356, 2017
18. Van Hal SJ, Jensen SO, Vaska VL y col. Predictors of Mortality in Staphylococcus aureus Bacteremia. Clin Microbiol Rev 25:362,2012.
19. Kaasch AJ, Barlow G, Edgeworth JD y col. Staphylococcus aureus bloodstream infection: A pooled analysis of five prospective, observational studies. J Infect 68: 242-251, 2014.
20. Jokinen E, Laine J, Huttunen R y col. Trends in incidence and resistance patterns of Staphylococcus aureus bacteremia. Infect Dis (Lond). 50:52-58, 2018.
21. Seymour CW ,Liu VX, Iwashyna TJ y col. Assessment of Clinical Criteria for Sepsis For the Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3). JAMA 315:762-774, 2016.
22. Kang CI, Song JH, Chung DR. Clinical impact of methicillin resistance on outcome of patients with Staphylococcus aureus infection: a stratified analysis according to underlying diseases and sites of infection in a large prospective cohort. J. Infect 61:299 –306, 2010.
23. Tibavizco D, Rodríguez J, Silva E, Isabel Cuervo E y col. Enfoque terapéutico de la bacteriemia por Staphylococcus aureus. Biomédica.27:29-307, 2007.
24. Klevens RM ,Morrison MA, Nadle J y “col.”Invasive Methicillin-Resistant Staphylococcus aureus Infections in the United States. JAMA. 29(15):1763-71,2007.
25. Khatib R ,Saeed S,Sharma M y col. Impact of initial antibiotic choice and delayed appropriate treatment on the outcome of Staphylococcus aureus bacteremia. Eur J Clin Microbiol Infect Dis 25: 181–85, 2006.
26. Mermel LA, Farr BM, Sherertz RJ y col. Guidelines for the Management of Intravascular Catheter–Related Infections. Clin Infec Dis 32:1249–72, 2001.
27. Esteban J, Marín M, Meseguer MA, Sánchez Somolinos M. Procedimientos en Microbiología Clínica Recomendaciones de la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica. Editores: Cercenado E y Rafael Cantón.2009.
28. Kim SH, Park W, Lee C y col. Outcomes of inappropriate empirical antibiotic therapy in patients with Staphylococcus aureus bacteraemia: analytical strategy using propensity scores. Clin Microbiol Infect 12:13–21, 2006.
29. Fowler VJ ,Olsen MK, Corey GR y col. Clinical identifiers of complicated bacteriemia. Arch Intern Med 163:2066- 2072, 2003.
30. Del Rio A, Cervera C, Moreno A y col. Patients at Risk of Complications of Staphylococcus aureus Bloodstream Infection. Clin Infect Dis 48: S246–S253, 2009.
31. Fowler VJ .Complications of Staphylococcus aureus bacteremia. Up to Date. 2013.
32. Khatib R, Johnson LB, Fakih MJ y col. Persistence in Staphylococcus aureus bacteremia: incidence, characteristics of patients and outcome. Scand J Infect Dis 38:7–14, 2006.
33. JungN, Rieg S. Essentials in the management of S. aureus bloodstream infection. Infection 46:441-442, 2018.
34. Fang CT. Early empirical glycopeptide therapy for patients with methicillin-resistant Staphylococcus aureus bacteraemia: impact on the outcome. J Antimicrob Chemother57:511–519, 2006.
35. Guilarde AO, Turchi MD, Martelli CM, Primo MG. Staphylococcus aureus bacteraemia: incidence, risk factors and predictors for death in a Brazilian teaching hospital. J Hosp Infect 63:330 –336, 2006.
36. Wang JT. Risk factors for mortality of nosocomial methicillin resistant Staphylococcus aureus (MRSA) bloodstream infection with investigation of the potential role of community-associated MRSA strains. J Infect 61:449– 457, 2010.
37. Park SY, Son JS, Oh IHb y col. Clinical impact of methicillin-resistant Staphylococcus aureus bacteremia based on propensity scores. Infection 39:141–147, 2011.
38. Perencevich EN. Excess shock and mortality in Staphylococcus aureus related to methicillin resistance. Clin Infect Dis 31:1311–1313, 2000.
39. Turnidge JD, Kotsanas D, Munckhof W y col. Staphylococcus aureus bacteraemia: a major cause of mortality in Australia and New Zealand. Med J Aust 191:368–373, 2009.
40. Cosgrove SE, Qi Y, Kaye KS y col. The impact of methicillin resistance in Staphylococcus aureus bacteremia on patient outcomes: mortality, length of stay, and hospital charges. Infect Control Hosp Epidemiol 26:166 –174, 2005.
41. Hewagama S, Spelman T , Einsiedel LJ. Staphylococcus aureus bacteraemia at Alice Springs Hospital, Central Australia, 2003–2006. Intern Med J 42:505-512, 2012.
42. Van Hal SJ, Jones M, Gosbell IB y col. Vancomycin heteroresistance is associated with reduced mortality in ST239 methicillin- resistant Staphylococcus aureus blood stream infections. PLoS One 6:e21217, 2011.
43. Truong J, Veillette Outcomes of vancomycinJJ, Forlanda SC. -lactam versus vancomycin only for the plus a treatment of methicillin-resistant Staphylococcus aureus bacteremia. Antimicrob Agents Chemother 62: e01554- 17, 2018.
44. Lesens O, Methlin C, Hansmann Y y col. Role of comorbidity in mortality related to Staphylococcus aureus bacteremia: a prospective study using the Charlson weighted index of comorbidity. Infect. Control Hosp Epidemiol 24: 890–896, 2003.
45. Big C, Malani PN. Staphylococcus aureus bloodstream infections in older adults: clinical outcomes and risk factors for in-hospital mortality .J Am Geriatr Soc 58:300 –305, 2010.
46. Chen SY, Wang JT, Chen TH y col. Impact of traditional hospital strain of methicillinresistant Staphylococcus aureus (MRSA) and community strain of MRSA on mortality in patients with community-onset S aureus bacteremia. Medicine (Baltimore) 89:285–294, 2010.
47. Ammerlaan H, Seifert H, Harbarth S y col. Adequacy of antimicrobial treatment and outcome of Staphylococcus aureus bacteremia in 9 Western European countries. Clin Infect Dis 49:997–1005, 2009.
48. Prybylski JP. Vancomycin Trough Concentration as a Predictor of Clinical Outcomes in Patients with Staphylococcus aureus Bacteremia: A Meta-analysis of Observational Studies. Pharmacotherapy 35:889–898, 2015.
49. Ruiz J, Ramirez P, Concha P y col. Vancomycin and Daptomycin Minimum Inhibitory Concentration as a predictor of methicillin-resistant Staphylococcus aureus Bacteremia outcome. J Glob Antimicrob Resist. 2018 14:141-144, 2018.
50. Kalil AC, Van Schooneveld TC ,Fey PD, Rupp ME. Association Between Vancomycin Minimum Inhibitor Concentration and Mortality Among Patients With Staphylococcus aureus Bloodstream Infection A Systematic Review and Meta-analysis. JAMA.312:1552-1564, 2014.
51. Welsh KJ, Skrobarcek KA, Abbott AN y col. Predictors of Relapse of Methicillin-Resistant Staphylococcus aureus Bacteremia after Treatment with Vancomycin. J Clin Mirocbiol 49;3669–3672, 2011.